Российский фармацевтический рынок уверенно растет уже третий год подряд. Только в прошлом году его емкость увеличилась почти на девять процентов и составила 1,4 триллиона рублей. А по итогам нынешнего года она почти наверняка превысит полтора триллиона. Но если раньше главным драйвером роста были государственные закупки лекарств, то теперь в лидеры наконец-то выбился коммерческий сегмент. Это не могло не сказаться на структуре продаж. Доля дешевых препаратов резко снизилась — люди все чаще выбирают дорогие лекарства. Но вот качество препаратов зачастую далеко от идеала. И, в общем, понятно почему. Еще совсем недавно в нашей стране просто не было фармацевтического инспектората, специалисты которого могли бы провести оценку лекарственных средств, завозимых в нашу страну из всех уголков мира, на соответствие установленным правилам и стандартам GMP (Good Manufacturing Practice). Ситуация изменилась только три года назад, когда Минпромторг наделил соответствующими полномочиями Государственный институт лекарственных средств и надлежащих практик (ГИЛС и НП). Это позволило не только резко сократить долю некачественных препаратов на нашем рынке, но и повысить стандарты производства лекарств в России. О том, как будут развиваться наша фармацевтическая промышленность и рынок лекарственных средств, о его регулировании и о результатах проведенных инспекций в интервью «Эксперту» рассказал директор ГИЛС и НП Владислав Шестаков.
— Вы как-то говорили, что России нужно делать ставку на создание инновационных лекарственных средств, поскольку именно они станут главным драйвером развития нашей фармацевтической промышленности. А что будет с дженериками?
— Нет ничего плохого в производстве дженериков. Есть развитые страны, где доля потребления таких препаратов довольно высока и местных регуляторов это ничуть не беспокоит. На самом деле все зависит от того, какую политику проводит государство в части потребления лекарств. Например, в США в шестидесятых годах прошлого века сделали ставку только на инновационные препараты. Это привело к тому, что продолжительность жизни значительно увеличилась, но вместе с тем резко выросли и расходы бюджета на медицину. Тогда же начался стремительный рост компании Teva — первого крупного производителя дженериков. Правда, впоследствии один из ее создателей перешел на работу в американскую систему здравоохранения и, чтобы снизить траты бюджета, предложил массово использовать не оригинальные препараты, а их более дешевые копии. Тем не менее в США успешно развиваются оба направления.
У нас же на первых порах стояла другая задача — заместить импорт. Не секрет, что на российском рынке преобладают дженерики. Причем до недавнего времени значительная их часть была импортного производства. И только благодаря госпрограмме «Фарма 2020» импорт удалось серьезно потеснить. Наши производители демонстрируют очень серьезный рост практически по всей номенклатуре жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП). Если брать список таких препаратов в целом, то еще пять лет назад на долю российских производителей приходилось 63 процента, а сейчас уже почти 85 процентов. Причем по некоторым группам Россия совершила настоящий рывок: доля отечественных лекарств для лечения ВИЧ-инфекции в системе государственных закупок выросла более чем втрое, а противотуберкулезных — на четверть. То есть успех в производстве аналоговых препаратов на лицо. Но этого недостаточно для того, чтобы наша фармацевтическая промышленность динамично развивалась в долгосрочной перспективе. Именно поэтому нужно сосредоточить усилия на инновациях, на разработке современных и важных для российской медицины оригинальных лекарств. Уверен, что наша страна в состоянии создать настоящий мировой блокбастер.
— Что для этого нужно сделать?
— Здесь требуются усилия не только Минпромторга и наших ведущих научно-исследовательских учреждений, но и венчурных фондов, а также институтов развития — «Роснано», РВК, «Сколково». Но самое важное, конечно же, механизмы поддержки. Приведу пример, о котором говорят все международные эксперты. Есть страны, которые сравнительно недавно решили, что фармацевтика — приоритетное для них направление, как с точки зрения развития инноваций, так в плане будущего экспорта. Это Сингапур, Ирландия и Пуэрто-Рико. Все они стали делать оригинальные препараты. Так вот, в Сингапуре для производителя инновационного препарата с экспортным потенциалом НДС отменен на десять лет. В Пуэрто-Рико такие компании еще совсем недавно НДС тоже не платили, но сейчас ставка для них выросла до четырех процентов. В Ирландии она составляет двенадцать процентов. Ясно, куда пойдет бизнес, — туда, где для него созданы условия. У нас весьма благоприятные условия сделали, например, в Калуге, где появился фармацевтический кластер. Сейчас очень многие компании хотят стать его резидентами.
— Какими должны быть условия?
— Прежде всего это инфраструктура, которая съедает почти сорок процентов проектной стоимости объекта. Нужно, чтобы к площадке были подведены газ, вода, построены подъездные пути. Если все это есть, то сами корпуса можно возвести за год — технологии строительства сделать это позволяют. Создав такие условия, мы можем рассчитывать, что к нам придут крупнейшие мировые разработчики, наладят партнерство с нашими ведущими университетами и в этой кооперации создадут новые препараты.
— А дженерики окончательно уйдут в прошлое? Или у таких препаратов все же есть какой-то потенциал?
— Они, безусловно, останутся. Более того, считаю, что в новой госпрограмме «Фарма 2030» должна быть четко прописана экспортная стратегия нашей фармацевтической отрасли, а именно — с какими препаратами мы выйдем на мировой рынок. Понятно, что продвигать какие-то устаревшие дженерики абсурдно. В том числе из-за крайне низкой маржи. На мой взгляд, Россия может предложить дженериковые препараты первого-второго поколения — это аналоги оригинальных лекарств, у которых только что закончилась патентная защита. А выходить с ними надо в те страны, где нас в принципе ждут и где есть политическая воля сотрудничать с Россией. Это государства Африки, Латинской Америки и Азии. Понятно, что там есть серьезные конкуренты — индийские и китайские компании. Но думаю, что здесь мы можем взять соотношением цены и качества. То есть при прочих равных выиграть эту борьбу, ну или, во всяком случае, составить серьезную конкуренцию Индии и Китаю.
— Мы сами в состоянии создавать оригинальные препараты? Есть ли у нас хоть какой-то задел?
— У нас есть талантливые специалисты, но их мало и они разрознены. Поэтому крайне важно наладить межведомственное взаимодействие, создать кооперацию институтов. И самое главное — поставить им конкретную задачу, как это было в советское время, когда государство мобилизовало весь интеллектуальный потенциал для достижения какого-то конкретного результата. На нынешнем этапе считаю архиважной задачей иметь все вакцины отечественного производства для национального календаря прививок. То есть мы должны закрывать все инфекции, включая ротавирусную, собственными иммунобиологическими препаратами. Следующий приоритет — противоопухолевые препараты и лекарства для лечения сердечно-сосудистых заболеваний.
— В какой сфере производства лекарств у нас самая тревожная ситуация?
— Если говорить о том, чего у нас нет, то это отечественные лекарства для детей. Здесь у нас почти все импортное. Всем ясно, что это очень сложная тематика, требующая серьезных инвестиций в клинические исследования. А значит, необходимы такие же серьезные меры государственной поддержки, которые простимулируют компании идти в эту нишу. Насколько я знаю, Минпромторг заложил в программе новой стратегии «Фарма 2030» направление педиатрии как приоритетное. Наши коллеги из фармацевтической индустрии говорят, что с готовностью инвестировали бы в это направление, если бы понимали объем гарантированного заказа. Иными словами, им нужно четко знать, когда они смогут вернуть свои вложения. Не надо забывать, что фарма предполагает очень длинный срок окупаемости, как правило, он составляет от семи до десяти лет. Но без гарантированного сбыта вряд ли кто-то отважится реализовать такой проект.
— А у нас вообще есть успешные примеры бизнеса западных компаний, которые организовали в России производство инновационных препаратов?
— Конечно есть. Можно вспомнить сотрудничество компании «Фармстандарт-УфаВита» с Roche по противоопухолевому препарату «Мабтера», с Johnson & Johnson — по препарату «Презиста» для лечения ВИЧ-инфекции, с Merck — по препарату «Ребиф», предназначенного для людей, страдающих рассеянным склерозом. На российской площадке локализовано производство их готовых лекарственных форм. Контрактное производство для иностранных компаний осуществляется и на многих других отечественных предприятиях. Есть ряд совместных проектов Abbott и «ХимРар» — они разрабатывают инновационные препараты в определенных нозологических зонах. Наконец, есть и чисто российские разработки. Например, «Биокад» вывел на рынок препараты для лечения рассеянного склероза, а Viriom — препарат «Элпида» для больных ВИЧ-инфекцией.
— А какую долю рынка в России занимают сейчас инновационные препараты?
— Наверное, порядка 10–15 процентов. Для сравнения: в США это 60–75 процентов. Но и расходы на медицину в Америке гигантские — порядка 17 процентов ВВП, то есть около 3,1 триллиона долларов.
— Объем фармацевтического рынка США — 465 миллиардов долларов. Понятно, что их рынок в состоянии потребить все инновационные лекарства, которые только создаются. А на какой спрос производители этих препаратов могут рассчитывать в России?
— Смотрите: рынок США действительно самый больший в мире, он составляет примерно половину мирового. У нас рынок несоизмеримо меньше, по итогам прошлого года — порядка 1,25 триллиона рублей (более 20 миллиардов долларов. — «Эксперт»). Но мы довольно динамично растем и входим в топ-15 крупнейших рынков, уступая Китаю и Бразилии. То есть траты на здравоохранение в России весьма значительные и на федеральном и на региональном уровне, что создает хорошие предпосылки для роста спроса на лекарства в будущем.
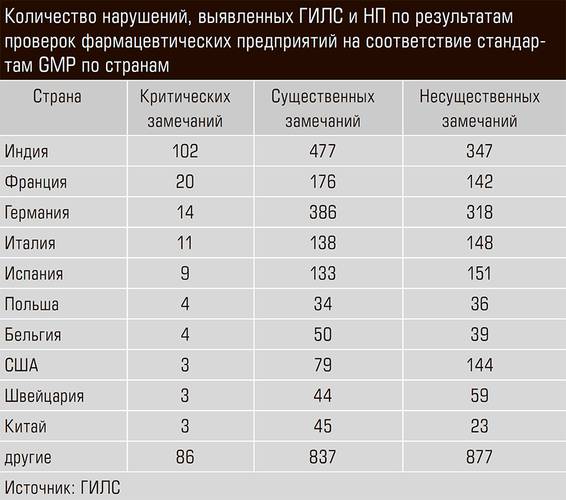
— Давайте перейдем непосредственно к деятельности ГИЛС и НП по инспектированию иностранных фармацевтических предприятий на предмет соответствия стандартам GMP. Сколько инспекций вы провели и каков их результат?
— Мы стартовали два года назад и за это время провели в общей сложности более девятисот инспекций. Если говорить о зарубежных производственных площадках, то только в прошлом году мы выявили свыше трех с половиной тысяч различных несоответствий. Из них к критическим были отнесены 266 (восемь процентов), к существенным — 1644 (47 процентов) и еще 1593 (45 процентов) были признаны несущественными.
— А можно конкретизировать эти нарушения? Например, критическое несоответствие — это просто какая-то фальсификация?
— Это, например, производство стерильных форм в ненадлежащих условиях, без соблюдения всех условий по обеспечению стерильности производственного процесса.
Это случаи, когда производственный процесс не прошел соответствующую первичную валидацию. Но большая часть несоответствий все-таки связана с нарушениями так называемых регистрационных досье, что не является критически важным. То есть компания при производстве препарата декларирует, что она делает то-то и то-то в соответствии с определенной документацией, но когда наши инспекторы приезжают на предприятие, то видят совершенно иную картину. Например, заявленная информация о производственной площадке не совпадает с таковой по факту.
— То есть там не фармацевтический завод, а условно говоря, казино?
— Нет, конечно, там именно фармацевтическое производство, только совершенно другого препарата. И иногда по другой технологии. Например, в процессе выпуска лекарства появилось какое-то новое вспомогательное вещество, но соответствующих изменений в регистрационное досье не внесли. Или производитель заменил субстанцию, но не проинформировал Минздрав.
— В каких странах вы выявили больше всего нарушений?
— Лидер по суммарному количеству несоответствий — Индия. Но надо понимать, что там очень много проверенных нами фармацевтических предприятий. А далее идут страны Евросоюза, в частности Франция и Германия. Единичные случаи встречаются в США, Японии.

— Не секрет, что препараты одного и того же производителя, например для лечения простуды, купленные в странах ЕС и в России, действуют по-разному. В первом случае эффект наступает быстрее, во втором — медленнее. Почему так происходит? Эти лекарства действительно чем-то различаются?
— Конечно, можно сослаться на субъективные реакции людей, но на самом деле все сложнее. Мы задавали этот вопрос коллегам из Ассоциации международных фармацевтических производителей (AIPM). Они отвечают: да, разница есть. Но это, дескать, потому, что у вас в России такие требования. Думаю, что причина в другом. А именно в использовании субстанций различного качества и цены.
— То есть та, что получше и подороже, применяется в препарате для рынка ЕС, а похуже и подешевле — для всех остальных…
— Сегодня основные поставщики субстанций — это Индия и Китай. Если вы посмотрите на ценовую политику этих производителей, то увидите, что одна и та же субстанция (с одинаковым названием. — «Эксперт») может иметь разную стоимость. Вот и получается, что есть лекарство, условно говоря, первого сорта, второго и так далее. Но так быть не должно, это просто неприемлемо. Пациент изначально надеется на эффективность препарата и его тождественность вне зависимости от страны приобретения.
— Но почему же тогда такое расхождение? И как его устранить?
— Считаю, что должны быть приняты комплексные меры, которые закроют этот вопрос. У нас в стране зарегистрировано 46 торговых названий диклофенака от 26 производителей и 18 торговых названий эналаприла от 16 производителей. Но их столько просто не нужно. Это огромная нагрузка на регуляторов, да и вообще на всех, кто контролирует эти производства. Пусть их будет десять. Но должна быть выработана какая-то методика, которая предотвратит появление на нашем рынке некачественных продуктов.
— Как вы можете регулировать этот процесс?
— Здесь у нас нет никаких полномочий. Это все контролируют Минздрав и Росздравнадзор. Первый отвечает за регистрацию, второй — за гражданский оборот. Мы же в своей части отвечаем только за соответствие производства требованиям и правилам, которые предъявляет наша страна.
— И если оно не соответствует, что тогда?
— Мы это так и отражаем в своем отчете, пишем, что существуют критические замечания. И Минпромторг на основании наших выводов принимает решение об отказе в выдаче заключения о соответствии. Недавно президент подписал поправки в закон «Об обращении лекарственных средств», согласно которому проведение инспекций и регистрация препарата должны идти параллельно. При этом если производитель не получает наш сертификат GMP, то к нему будут приниматься превентивные меры. В случае несоответствия требованиям GMP, которые причинили или могут причинить вред жизни и здоровью человека, все может закончиться приостановлением применения того или иного препарата.
— А как на практике строится подобная работа? Были случаи изъятия из оборота некачественных лекарств?
— Схема такова: мы проводим проверку и информируем Минпромторг, а он по цепочке Росздравнадзор, который уже принимает конкретные меры. Могу сказать, что за время нашей работы мы выявили несколько случаев, связанных с фальсификацией продукции. Причем Росздравнадзор довольно оперативно сработал, изъяв из оборота препараты ряда известных компаний, в том числе Sandoz. Конечно, они не были счастливы такому исходу, потому что это все-таки определенным образом влияет на репутацию.
— Но изъятие лекарств из оборота — крайняя мера. А что будет, если ГИЛС и НП, проведя проверку, найдет нарушения, и Минпромторг не выдаст сертификат GMP? Какие последствия повлечет такой шаг для производителя?
— До недавнего времени, кроме репутационных, никаких. Ну не получил он сертификат, обидно, конечно, но поставки на рынок все равно продолжались. Именно поэтому в рамках нынешних законодательных нововведений эту ситуацию предполагается в корне изменить.
— То есть с принятием нового закона такие поставки станут невозможны?
— Именно так. Ну или, во всяком случае, крайне затруднительны — предприятие будет испытывать значительные сложности, которые заставят его сделать продукцию надлежащего качества.
— Политика кнута и пряника?
— Да. Если предприятие сегодня получило отказ, то это не значит, что оно обречено на то, чтобы от его лекарств вообще отказались. Если все предписания будут выполнены, а нарушения устранены, то рынок вновь будет открыт.
— Какой у вас штат инспекторов и что это за люди?
— Сегодня у нас 62 инспектора. Все они имеют минимум десятилетний стаж работы в отрасли. Но есть и люди с двадцати- и даже тридцатилетним стажем, как правило на производствах в отделе контроля качества. Естественно, у них профильное образование — химическое или биологическое. В основном это МГУ, Санкт-Петербургская государственная химико-фармацевтическая академия и Сеченовский университет. При этом примерно треть наших специалистов имеют сертификат Всемирной организации здравоохранения, они закончили еще и фармацевтический колледж Pharmakon в Дании. Все это позволяет нам выдерживать очень жесткий график инспекций и даже идти с опережением. В целом на проведение инспекции нам дается 160 дней, но мы укладываемся в 90–115 дней. В результате на каждого сотрудника у нас приходится примерно по 50 инспекций в год. Это почти вдвое больше, чем в таких же инспекторатах в Европе.
— Давайте вернемся к показателям качества лекарств. Что ни говори, а восемь процентов выявленных вами критических несоответствий — это очень много. В чем причина, на ваш взгляд?
— Дело в том, что у нас до недавнего времени просто не было инспектората. А российский рынок воспринимался в мире как неконтролируемый. Более того, наши зарубежные коллеги на всех заседаниях говорили: «Зачем вам проводить инспекции, когда у производителя уже есть международный сертификат GMP — вы его автоматически признавайте, и все!» То есть это такой специфический подход, как в английском закрытом клубе, где принято верить на слово. Такое отношение объясняется тем, что при регистрации препаратов в России у нас никто не проверял производственную площадку. Главное было хорошо сделать документы и отдать их в Минздрав. Некоторое время назад проверки проводил Росздравнадзор, но и то выборочно. Соответственно компании зачастую очень фривольно относились к правилам. Ну, заменил одну субстанцию на другую, или же вообще состав поменял, ну и что? Препарат же как-то работает. Но сейчас, когда появился инспекторат, мы, конечно, стали очень неудобны для многих компаний — им приходится менять не только стиль работы, но и зачастую сами технологии.
— А как происходит взаимодействие в этой области в рамках ЕАЭС?
— На сегодняшний день у нас действует правило о взаимном признании сертификатов, выданных локальному производителю. Иными словами, если такая компания получила соответствующий документ, скажем, в Армении, Киргизии, Белоруссии или Казахстане, то мы автоматически обязаны его признать. И наоборот. На следующем этапе, с 2021 года, предполагается, что все страны ЕАЭС перейдут на наднациональные правила. Это означает, что все инспекции будут проводиться по единому стандарту. То есть производитель сможет прийти на рынок Киргизии, пройти там инспекционную проверку и дальше свободно продавать свой препарат в России.
— И это открывает перед некоторыми компаниями своего рода окно возможностей, когда пройти проверку, например, в Киргизии будет намного легче, чем в России…
— Совершенно верно. Именно такая ситуация сейчас сложилась у ветеринаров. Например, в Армении компания регистрирует какую-то вакцину, но ее там не продает, а завозит в Россию. И это создает так называемые зоны риска. Поэтому мы настаиваем на том, чтобы инспектораты стран ЕАЭС были одинаково подготовлены и действовали по единым правилам. А критерии оценки производственной площадки во всех странах ничем не отличались.





