Электроотрицательность — способность атома оттягивать на себя электроны, и она во многом определяет его химические свойства. Самая высокая электроотрицательность у галогенов и сильных окислителей, а самая низкая — у щелочных металлов. «Если честно, мы и не собирались менять понятие электроотрицательности. Это незапланированный результат», — рассказывает Артем Оганов.
Артем Оганов — один из самых цитируемых российских ученых, создатель программы USPEX, которая регулярно предсказывает новые необычные химические соединения под высоким давлением, и эти предсказания находят подтверждение в эксперименте. И в этот раз они с Кристианом Тантардини решили найти фундаментальные обоснования для «нестандартной» химии высоких давлений.
«Самые фундаментальные свойства атомов — объем (радиус), поляризуемость и электроотрицательность, — рассказывает Оганов. — Самым нетривиальным свойством атомов как раз и является электроотрицательность. Понятно, скажем, что объемы атомов падают с ростом давления. А что происходит с электроотрицательностью?»
Статья о химии высоких давлений уже закончена и содержит, как говорят авторы, неожиданные результаты. Но для того, чтобы рассмотреть электроотрицательность под высоким давлением, им необходимо было проверить, как работают их расчеты под нормальным. И тут, к их удивлению, обнаружилось, что классическая формула, вошедшая во все учебники, не работает!
Самое первое и самое распространенное понятие электроотрицательности было придумано великим химиком нобелевским лауреатом Лайнусом Полингом в 1932 году. Его формула очень проста и понятна даже школьникам. Электроотрицательность считается из разницы между всей энергией химической связи и ковалентной частью этой энергии (энергией связи в неполярных молекулах). Разница — это ионная прибавка в энергии, которую и дает оттягивание электронов. «Грубо говоря, чем сильнее различие атомов, тем лучше для химической связи», — говорит Оганов.
Например, можно определить энергию связи лития и фтора в соединении Li-F; при их соединении выделяется много энергии. Отдельно можно посчитать энергии соединении Li-Li и F-F. Первая энергия будет существенно больше, чем среднее двух других. В этой разнице и «сидит» электроотрицательность. Если точнее, то, по Полингу, разница этих энергий равна квадрату разницы электроотрицательностей лития и фтора.
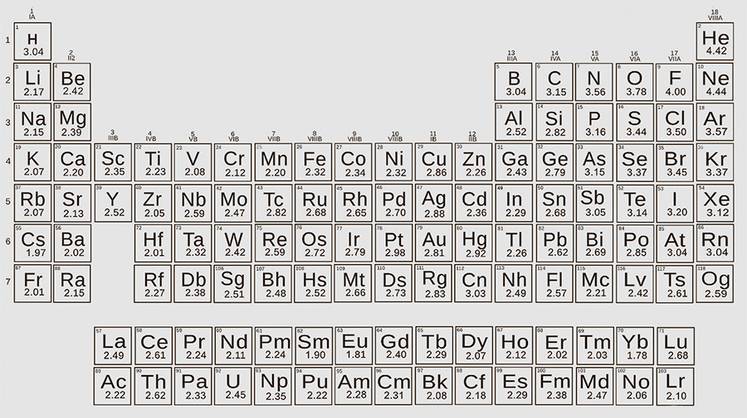
«Рассчитать электроотрицательности несложно. Это немного муторно (для всех элементов-то), но вполне решаемо: нужно запастись терпением, временем и вычислительным ресурсом. Мы начали это делать, — говорит Оганов. — И тут выяснилось, что из энергий связей невозможно получить электроотрицательности, приведенные в каждом учебнике. Мы обратились к экспериментальным данным и тоже не нашли совпадений. Вообще непонятно, откуда взялась таблица значений электроотрицательности. Это загадка. Если порыться в литературе, то оказывается, что этот эффект был известен. Но мы были потрясены тем, что он упоминается вскользь, шепотом, у него даже есть смешные называния, например “размерный эффект”.
Таблица электроотрицательностей “из учебника” содержит много нелогичных странностей, например некоторые металлы оказываются более отрицательными, чем водород или бор, что противоречит опыту и здравому смыслу. Кроме того, применение формулы Полинга оказывается не самосогласованным: электроотрицательности лития получатся разными в зависимости от того, считать их из соединения Li-В или из Li-F. Формула Полинга лучше работает при маленькой разнице электроотрицательнсотей, хотя полезнее ее применять при больших, когда ионная энергия больше».
И тут ученые увидели, в чем проблема. Если двигаться вниз по первому столбцу таблицы Менделеева и рассмотреть соединения Li-F, Na-F, K-F, Ru-F и Cs-F, то легко понять, что с ростом размера атомов соответственно растут расстояния между атомами и энергия связи должна падать (закон Кулона: обратно пропорционально расстоянию). А раз так, то сверху вниз электроотрицательность должна расти, что нелогично, ведь большой цезий может отдавать свои дальние электроны проще, чем литий. И это потому, что формула Полинга считает разницу энергий без учета размеров атомов, как если бы все они были одинаковыми.
«И я понял, что электроотрицательность надо считать не из абсолютной, а из относительной разницы ионной и ковалентной энергий. Важно не насколько ионизация повышает энергию связи, а во сколько раз, — говорит Артем Оганов. — Это же логично! Мы совсем чуть-чуть прикоснулись к формуле Полинга, и тут посыпались сюрпризы. Мы получили другие величины, и они прекрасно ложатся во все тренды периодической таблицы. Электроотрицательность падает от лития к цезию, растет от лития к фтору. Все красиво и четко, энергии связей вырастают из нашей таблицы».
Кроме того, новые электроотрицательности отлично предсказывают не только энергии химических реакций, но еще и проводимость, свойства кристаллов, цвет. Так в качестве побочного результата исследований получился результат, потрясший основы школьной химии и давший простой и удобный инструмент для оценки и расчета свойств соединений. «Как по мне, это тривиально, — сказал Артем Оганов. — Я вообще в своей жизни ничего сложного не делал. И в этот раз: вместо сложения в формуле — умножение. Это же детский сад! Но удивительно, что этот детский сад работает».